새로운 기술은 더 강력하거나 광범위한 면역을 제공할 수 있지만 시장 점유율을 위해 싸워야 합니다.
NEWS FEATURE
01 February 2023
The next generation of coronavirus vaccines: a graphical guide
New technologies might provide more potent or broader immunity — but will have to fight for market share.
https://www.nature.com/articles/d41586-023-00220-z
의 간단 번역입니다.
Ewen Callaway
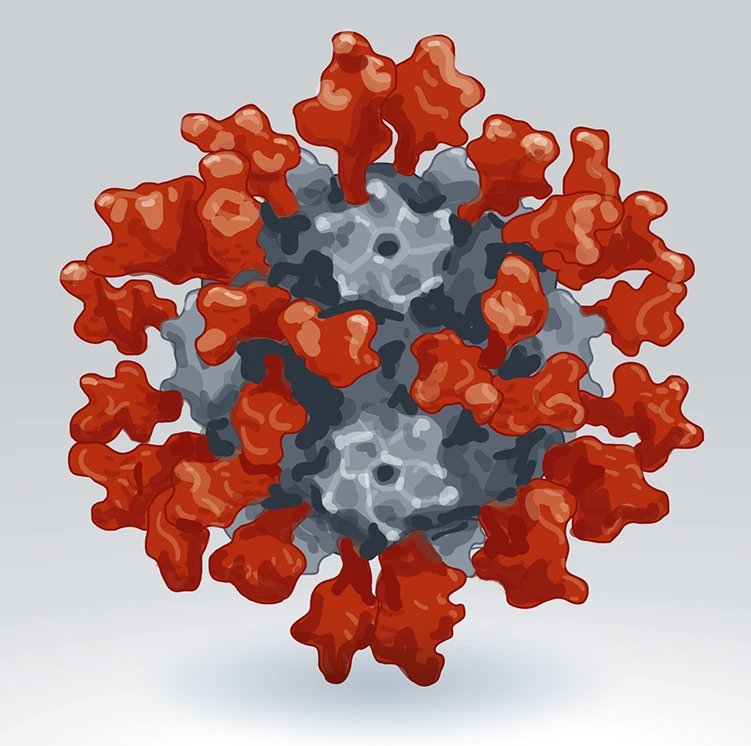
2022년에 승인된 한국 회사 SK 바이오사이언스의 나노입자 백신. 닉 스펜서/네이처. A. C. 월스 외. 셀 183, 1367–1382 (2020).
코로나바이러스 SARS-CoV-2에 대한 백신은 COVID-19로부터 보호하기 위해 수십억 명의 사람들에게 제공되었으며 20백만명 이상의 생명을 구했습니다. 그러나 바이러스 변이는 원래 백신이 제공하는 면역 일부를 피할 수 있습니다. 그 결과, 전 세계의 백신 개발자들은 첫 번째 버전의 업데이트뿐만 아니라 새로운 기술과 플랫폼을 사용하는 수십 개의 ‘차세대’ COVID-19 백신을 개발하고 있습니다.
이러한 백신은 다양한 그룹이지만 가장 중요한 목표는 바이러스 변화에 탄력적인 오래 지속하는 보호를 제공하는 것입니다. 일부는 아직 출현하지 않은 코로나바이러스를 포함하여 더 광범위한 종류의 코로나바이러스로부터 보호할 수 있습니다. 다른 사람들은 더 강력한 면역을 제공하거나, 더 낮은 용량으로 그렇게 할 수 있거나, 바이러스의 감염이나 전염을 예방하는 데 더 나을 수 있습니다.
이 차세대 백신에 대해 기대할 수 있는 사항은 다음과 같습니다.
더 많은 백신이 필요한 이유는 무엇입니까?
한마디로: 진화. 최초로 승인된 COVID-19 백신은 바이러스가 처음 확인된 이후 크게 변하지 않은 SARS-CoV-2 버전에 대한 보호 테스트를 거쳤습니다. 이 백신은 다양한 유형으로 제공되지만, 일부는 메신저 RNA로 구성되어 있고 다른 일부는 코로나바이러스 자체 또는 일부 단백질의 비활성화 버전이지만 모두 신체를 항원 (바이러스의 일부)에 노출해 질병을 일으키지 않고 면역 반응을 유발합니다.
대체로 이 면역 반응은 SARS-CoV-2가 세포를 감염시키는 것을 차단할 수 있는 항체를 생성하는 B 세포와 감염된 세포를 파괴할 수 있는(그리고 다른 면역 반응을 지원하는) T 세포에서 비롯됩니다.
예방 접종은 또한 초기 항체 수치가 감소한 후에도 장기간 면역을 위한 ‘기억 세포’ 풀을 생성합니다. 후속 감염 시 기억 B 세포는 증식하기 시작하여 더 많은 항체를 생성하는 세포로 분화합니다(‘코로나바이러스 백신이 SARS-CoV-2로부터 보호하는 방법’ 참조).
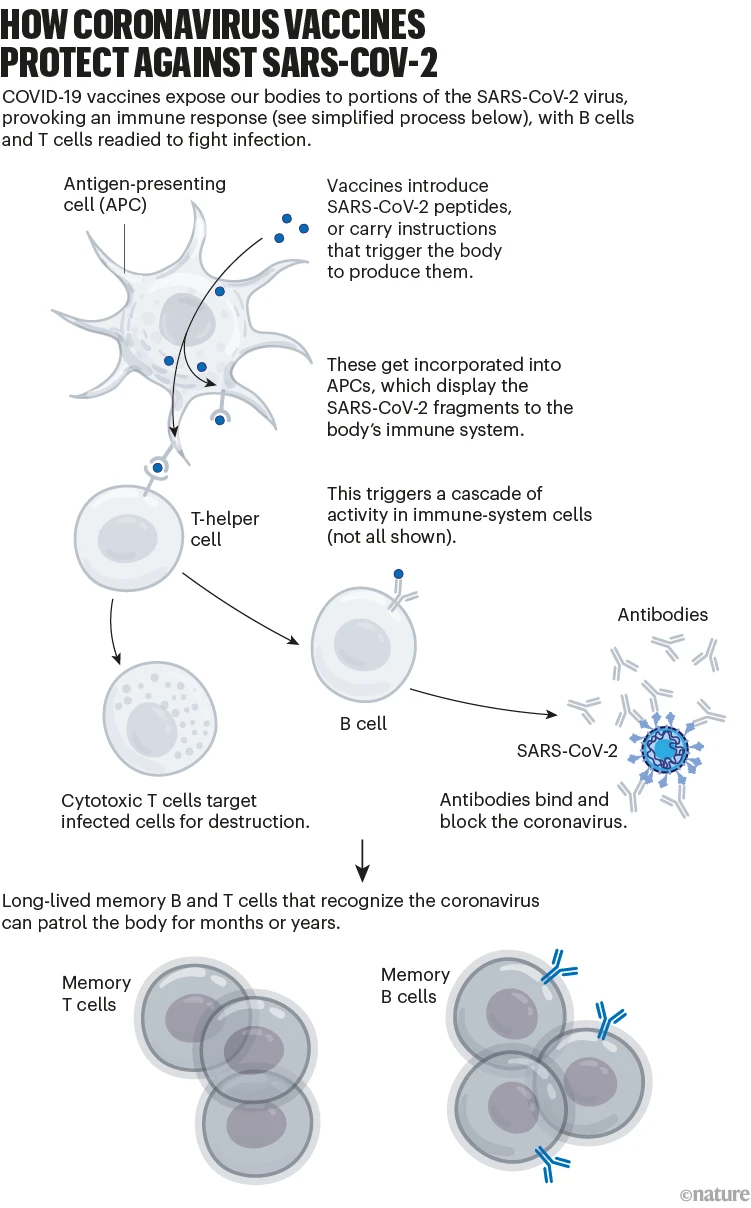
How coronavirus vaccines protect against Sars-CoV-2: a graphic that shows the process of how vaccines confer immunity.
닉 스펜서/네이처.
이러한 백신은 심각한 질병에 대한 오래 지속하는 보호를 제공하지만, 바이러스 감염에 대한 보호는 몇 달 안에 줄어들고 있습니다. 그리고 오미크론과 같은 SARS-CoV-2의 변종은 이후 이러한 면역 일부를 벗어날 수 있는 돌연변이로 진화했습니다. 예를 들어, 초기 백신에 의해 생성된 기억 반응은 오미크론에 쉽게 달라붙지 않는 항체를 생성합니다. 이는 감염에 대한 보호 감소에 이바지합니다(‘코로나바이러스 변종은 면역을 피함’ 참조).
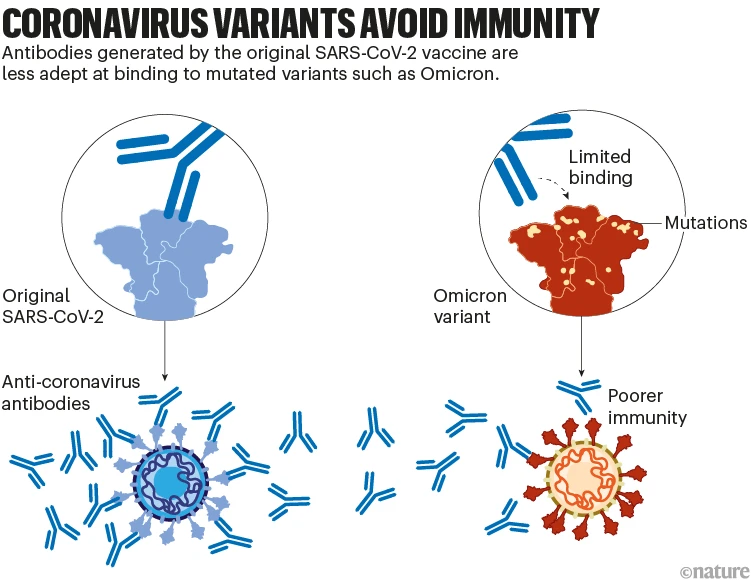
Coronavirus variants avoid immunity: a graphic that shows how mutations make antibodies less adept and binding to variants.
닉 스펜서/네이처.
오미크론 변종에 대한 면역력을 높이기 위해 2세대 백신이 이미 도입되었습니다. 바이러스 진화를 따라잡기 위해 백신에 대한 변종별 업데이트가 추가로 뒤따를 가능성이 크지만, 면역력이 약해지고 SARS-CoV-2가 더 진화함에 따라 백신이 제공하는 보호 기능이 특히 오래 지속할지는 확실하지 않습니다.
결과적으로 연구팀은 새로운 백신을 개발하기 위해 몇 가지 접근 방식을 취하고 있습니다.
업데이트된 백신
SARS-CoV-2 변이에 대처하기 위해 백신 개발업체인 화이자-바이오엔텍과 모더나는 작년에 업데이트된 mRNA 백신을 도입했습니다. 이들은 원래 바이러스와 Omicron의 스파이크 단백질 분자를 암호화하기 때문에 2가라고 합니다. (스파이크 단백질은 SARS-CoV-2가 세포에 결합하는 데 사용하는 것입니다.)
2가 백신은 여러 가지 방식으로 작동합니다. 다른 COVID-19 부스터 샷과 마찬가지로 이전 백신에 의해 이미 확립된 기억 B 세포를 자극합니다. 이 세포 반응 중 일부는 오미크론을 인식할 수 있는 항체로 이어집니다. 그들의 효능은 시간이 지남에 따라 강화될 수 있습니다: 오미크론의 스파이크가 제시되면 기억 B 세포는 돌연변이와 선택의 진화적 ‘훈련’과정을 거쳐 오미크론의 스파이크에 더 단단히 결합하는 항체를 암호화하는 B 세포 풀을 생성합니다. 마지막으로, 2가 백신의 오미크론 성분은 자체 항체를 생성하는 새로운 B 세포도 모집합니다(‘업데이트된 백신’ 참조).
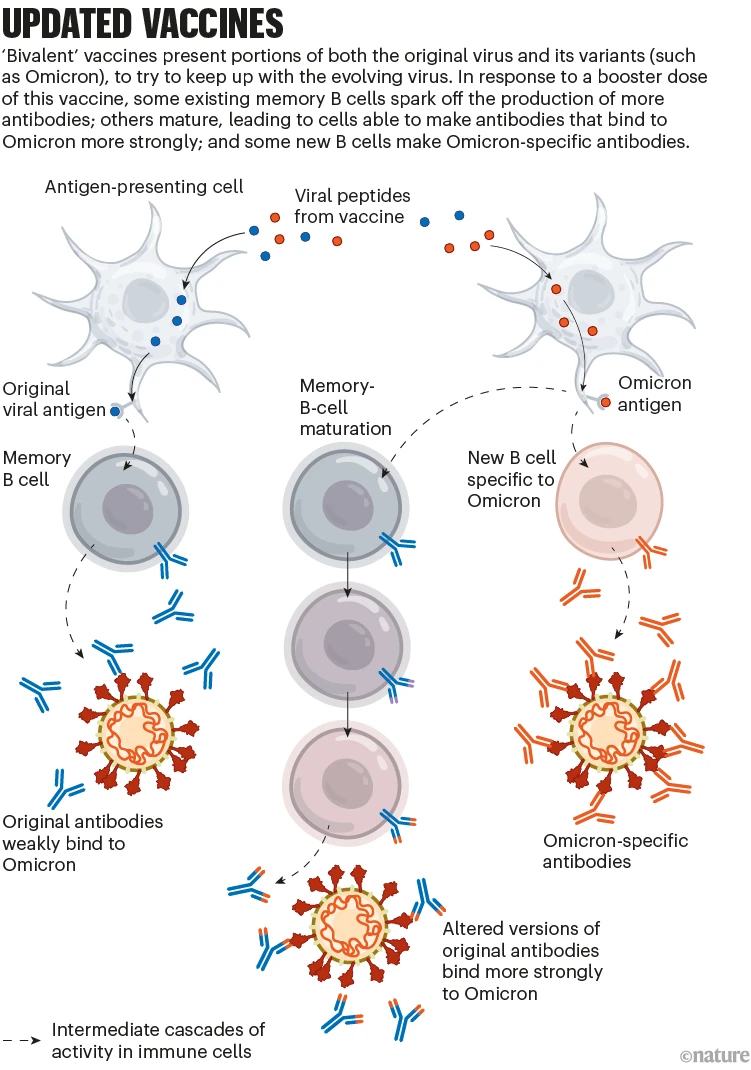
Updated vaccines: a graphic that shows how bivalent vaccines can help to give immunity to variants such as Omicron.
닉 스펜서/네이처.
이러한 효과는 2가 부스터가 원래 백신의 부스터 용량보다 오미크론에 대해 더 나은 보호를 제공한다는 것을 의미할 수 있습니다. 그러나 그 이점이 실제로 얼마나 중요한지는 여전히 불분명합니다.
화이자-바이오엔텍을 포함한 일부 개발자들은 COVID-19 및 기타 질병(가장 일반적으로 인플루엔자)으로부터 사람들을 보호하기 위해 복합 백신을 개발하고 있습니다. 거의 모든 것이 개발 초기 단계에 있습니다.
광범위한 보호 백신
COVID-19 백신에 대한 업데이트는 항상 진화하는 바이러스보다 한두 단계 뒤처져 있습니다. 과학자들은 미래의 SARS-CoV-2 변종과 관련 코로나바이러스를 표적으로 삼을 수 있는 ‘광범위하게 보호하는’ 백신을 개발하기를 희망합니다.
이러한 백신중 일부의 목표는 SARS-CoV-2 변이 및 일부 관련 코로나바이러스 종에서 보존되는 스파이크 단백질의 특정 영역에 대한 면역 반응을 생성하는 것이며, 이는 새로운 변종에서 돌연변이를 일으키지 않는 경향이 있음을 의미합니다. 관심 영역 중 하나는 수용체 결합 도메인(RBD)으로, 인간 세포의 ACE2 수용체 단백질에 결합하고 신체에서 가장 강력한 감염 차단 항체 중 일부에 의해 표적화됩니다.
시애틀의 워싱턴 대학교와 패서디나의 캘리포니아 공과대학(Caltech)에서 최소 두 팀이 ‘모자이크’ 백신을 만들고 있습니다: 흩어져 있는 나노 입자로 이루어진 SARS-CoV-2와 SARS-CoV 및 박쥐에서 분리된 다른 것과 같은 계열의 코로나바이러스(사르베코바이러스라고 함)의 RBD들.
B 세포가 이러한 모자이크 나노 입자에서 하나 이상의 RBD를 인식하면 (여러 바이러스 종의 보존 된 영역에 달라 붙음) 강하게 결합합니다. 이것은 차례로 B 세포가 증식하고 더 많은 항체를 생성하도록 촉발합니다. (미래의 감염과 싸우기 위한 기억 B 세포뿐만 아니라). 단 하나의 바이러스 종으로부터 RBD를 인식하는 B 세포는 약하게 결합하고, 이러한 반응을 생성하지 않는다. 연구원들은 모자이크 나노 입자를 사용하면 코로나바이러스 종에서 여러 RBD를 인식할 수 있는 항체 풀이 풍부해질 것으로 기대합니다 ( ‘광범위한 보호’참조).
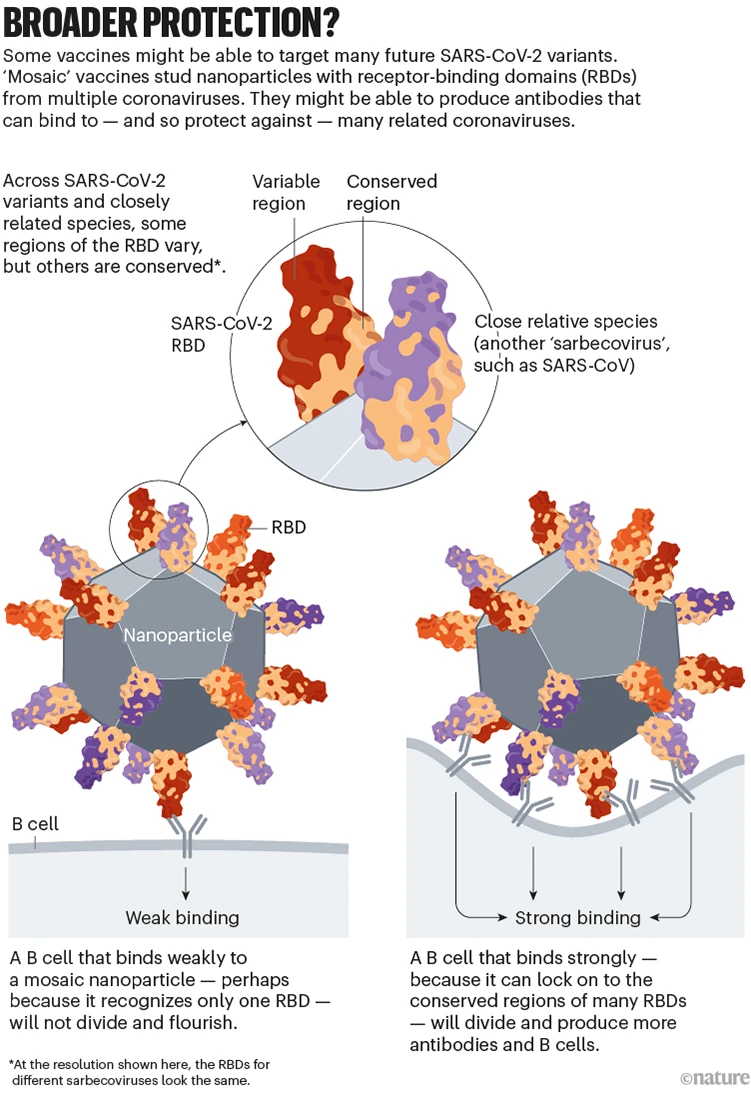
Broader immunity?: a graphic that shows how mosaic nanoparticle vaccines can provide immunity across a broad range of viruses.
닉 스펜서/네이처. 칼텍에서 적응 (https://go.nature.com/3R6GWJ3)
동물 연구에 따르면 이러한 백신은 다양한 사르베코바이러스에 대한 보호 반응을 유발합니다. 첫 번째 임상 시험은 향후 2년 내에 시작될 예정입니다.
스파이크를 넘어서
많은 1세대 COVID-19 백신은 SARS-CoV-2의 스파이크 단백질에 대해서만 면역 반응을 유발합니다.
그러나 일부 차세대 백신은 감염 때문에 부여되는 보호를 안전하게 모방하는 보다 다양한 면역 반응을 생성하기 위해 다른 바이러스 단백질도 전달합니다. 이 접근법은 또한 새로운 스파이크 변이의 영향을 완화할 수 있습니다. ( ‘다른 바이러스 단백질 표적화’참조).
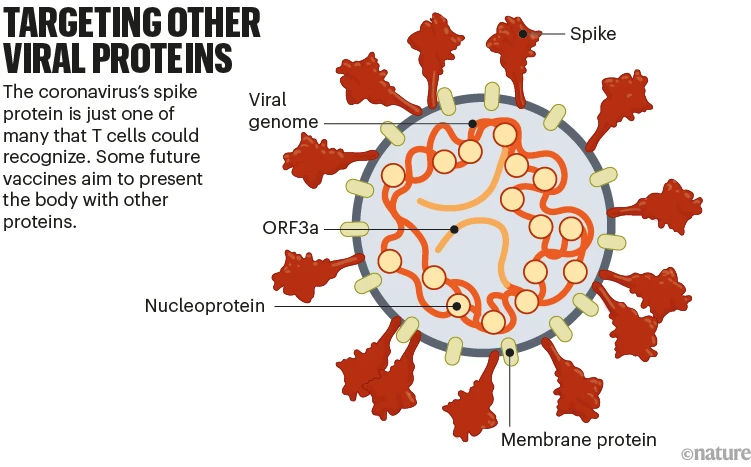
Targeting other viral proteins: a graphic that shows some of the other proteins in Sars-CoV-2 that can be used in vaccines.
닉 스펜서/네이처. 스탠포드 대학교에서 적응 (https://go.nature.com/3WV2FB6)
스파이크 단백질은 항체 생성 B 세포의 주요 표적입니다. 그러나 감염된 세포를 파괴하는 T 세포는 다른 많은 SARS-CoV-2 단백질을 인식할 수 있습니다. 이러한 이유로 다른 단백질을 전달하는 백신은 면역 체계가 강력한 항체 반응을 일으키지 않는 사람들을 보호하는 데 도움이 될 수 있습니다. 이러한 백신은 또한 스파이크가 아닌 단백질이 변종 간에 덜 변하는 경향이 있으므로 바이러스 진화에 더 탄력적 일 수 있습니다.
미국 생명공학 회사인 Gritstone은 mRNA 백신 기술을 사용하여 여러 SARS-CoV-2 단백질에 대한 지침을 제공하는 그러한 백신중 하나를 개발하고 있습니다. 한편 텍사스의 생명 공학 회사인 Vaxxinity는 신체를 여러 항원에 노출하는 단백질 기반 백신을 개발하고 있습니다. 이 회사는 임상 3상 시험에서 백신이 안전하고 부스터로 사용될 때 강력한 항체 반응을 유도한 후 올해 영국과 호주 승인을 신청할 계획이라고 밝혔다.
새로운 플랫폼 디자인
차세대 백신을 분류하는 또 다른 방법은 신체에 전달하는 방법입니다. 기존 백신은 적어도 네 가지 접근법 중 하나를 사용합니다: 핵산 백신 (대부분 mRNA)은 세포에 SARS-CoV-2 스파이크 단백질을 만들도록 지시합니다. 비활성화된 백신은 코로나 바이러스 자체의 버전을 사용합니다. 단백질 백신은 스파이크 단백질 또는 그의 RBD로 구성됩니다. 바이러스 벡터 백신은 변형된 바이러스를 사용하여 스파이크 단백질에 대한 지침을 세포로 셔틀 합니다. 차세대 백신에는 이러한 설계에 대한 조정 또는 성능 향상을 위한 전달 메커니즘의 변경이 포함될 수 있습니다.
자가 증폭 RNA
mRNA 백신은 특히 대부분 용량이 판매된 부유한 국가에서 전염병의 흐름을 바꾸는 데 도움이 되었습니다. 이 기술을 비틀면 부작용을 최소화하면서 백신을 더 저렴하고 강력하게 만들 수 있습니다.
화이자-바이오엔텍과 모더나(미국 국립 알레르기 및 전염병 연구소)가 개발한 백신은 지방 나노입자에 포장된 수정된 버전의 스파이크에 대한 mRNA 지침으로 구성됩니다. 이 기술의 업데이트된 버전에서 자가 증폭 RNA(saRNA) 백신에는 세포가 더 많은 스파이크 사본을 휘젓도록 지시하는 효소에 대한 지침도 포함되어 있습니다(‘자가 증폭 RNA’ 참조).
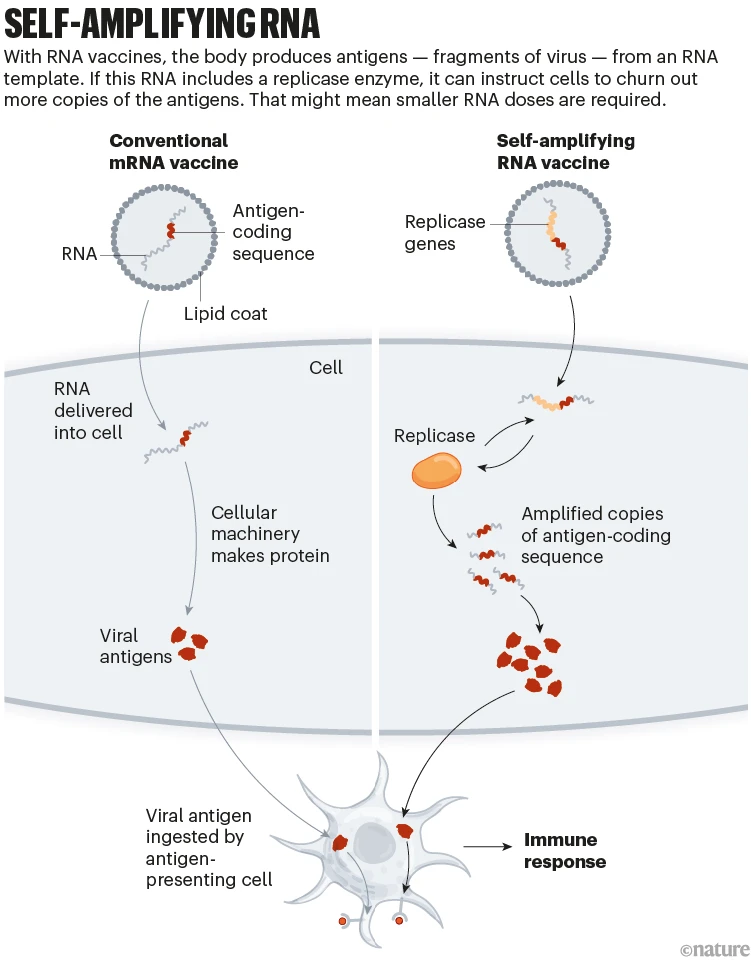
Self amplifying RNA: a graphic that shows how genes can be added to RNA vaccines to make them more effective.
닉 스펜서/네이처.
이는 더 작고 잠재적으로 더 저렴한 용량의 saRNA 백신이 기존 mRNA 백신과 비교하여 같거나 더 강한 면역 반응을 달성할 수 있음을 의미합니다. 더 작은 초기 복용량은 또한 부작용을 줄일 수 있습니다.
미국 회사 아크튜러스 테라퓨틱스가 개발한 saRNA 백신이 2022년 4월 임상 3상 시험을 완료했습니다. 이 회사는 현재 일본에서 또 다른 임상 3상 시험을 시작하여 승인 신청으로 이어질 수 있다고 말합니다. Gritstone은 saRNA 기술을 사용하여 임상 1상 시험을 완료한 후보 T 세포 백신에 추가 SARS-CoV-2 단백질을 전달하고 있습니다.
나노 입자의 단백질
미국 생명공학 회사인 노바백스(Novavax)가 만든 백신을 포함하여 여러 단백질 기반 COVID-19 백신이 전 세계적으로 승인되었습니다. 저렴한 비용과 생산 용이성은 매력적입니다. 그들은 일반적으로 전체 SARS-CoV-2 스파이크 단백질 또는 RBD의 안정화된 형태로 만들어집니다.
이 백신의 새로운 부류는 스파이크 또는 RBD가 박힌 축구공 모양의 구조로 자체 조립되는 단백질로 만들어집니다. 실제 바이러스를 모방한 바이러스 분자의 반복적인 배열은 특히 강력한 면역 반응을 일으킵니다.
Caltech와 워싱턴 대학이 개발한 ‘모자이크’백신 (여러 종류의 코로나 바이러스의 RBD가 박혀 있음)은 이러한 노력의 한 예입니다.
또 다른 나노 입자 백신이 이미 승인되었습니다: 2022년 2월, 한국 규제 당국은 워싱턴 대학교에서 개발한 SARS-CoV-2 원본 버전의 RBD를 포함하는 백신을 승인했습니다. 임상 3상 시험에 따르면 이 백신은 스파이크 항원을 암호화하는 침팬지 아데노바이러스를 사용하는 아스트라제네카와 영국 옥스퍼드 대학에서 개발한 바이러스 벡터 백신에서 생성된 것보다 몇 배 더 높은 수준으로 항체 반응을 높였습니다.
그러나 백신을 개발하는 한국 회사인 SK 바이오 사이언스는 2022년 말 한국에서 백신에 대한 수요가 적어 생산을 일시 중지했다고 밝혔다.
메릴랜드 주 실버 스프링에있는 미국 월터 리드 육군 연구소 (Walter Reed Army Institute of Research)의 연구원들이 이끄는 팀은 페리틴이라는 철 운반 단백질을 사용하여 또 다른 단백질 나노 입자 백신을 개발하고 있습니다. 이것은 구형 입자로 자체 조립된 다음 전체 SARS-CoV-2 스파이크 단백질이 박혀 있습니다. 현재 초기 단계 시험에서 테스트 중입니다 ( ‘나노 입자 플랫폼’참조).
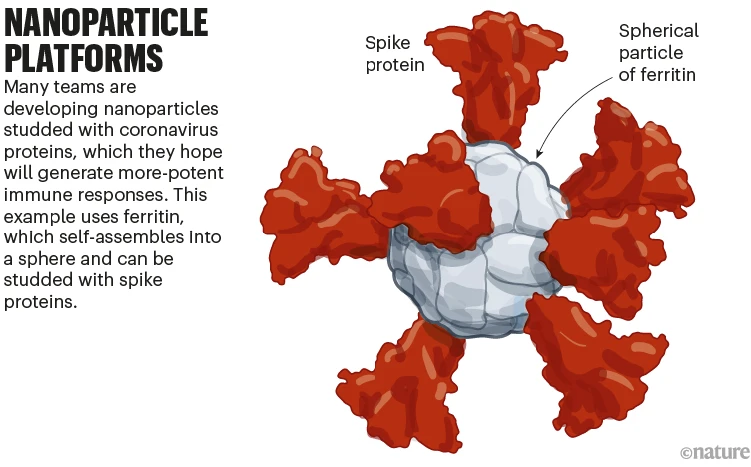
Nanoparticle platforms: a graphic that shows a spike ferritin nanoparticle vaccine.
닉 스펜서/네이처. 스탠포드 대학교 (https://go.nature.com/3WV2FB6) 및 WRAIR (https://go.nature.com/3JTX3XU)에서 채택
비강 백신
일부 COVID-19 백신은 코나 입을 통해 미스트로 흡입하거나 비강으로 흡입합니다. SARS-CoV-2가 코와 입을 감싸고 있는 얇은 점막에서 체내로 들어가는 지점에서 면역 반응을 유발함으로써 이 백신은 이론적으로 바이러스가 퍼지기 전에 막을 수 있습니다.
동물 연구 데이터에 따르면 이것이 가능할 수 있으며 중국에서 2개, 인도,이란, 러시아에서 각각 1개 등 최소 5개의 비강 백신이 이미 사용 승인을 받았습니다. 그러나 이러한 백신이 바이러스의 감염이나 전파를 줄이는 데 주사보다 나은지에 대한 데이터는 아직 없습니다(‘비강 백신’ 참조).
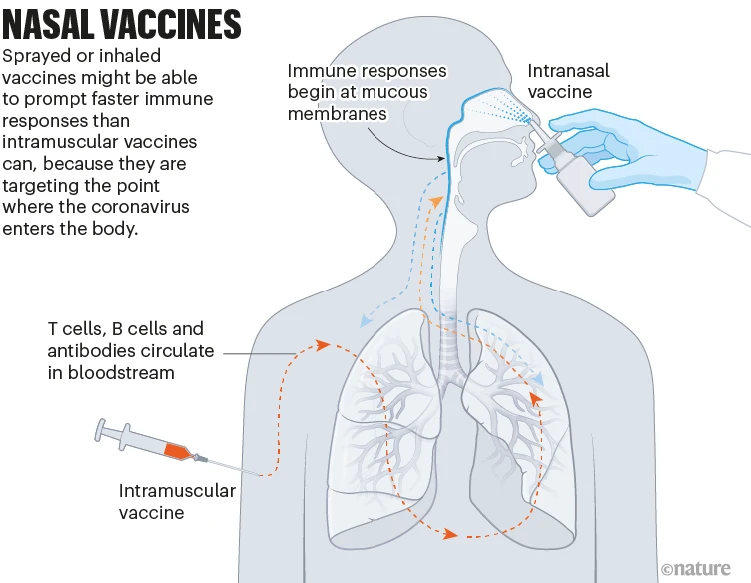
Nasal vaccines: a graphic that shows how nasal vaccines could start giving immunity at mucosal membranes in the nose and mouth.
닉 스펜서/네이처.
차세대 코로나19 백신의 선도적인 자금 제공자인 오슬로에 기반을 둔 재단인 전염병대비혁신연합(CEPI)의 백신 연구 개발 전무이사인 멜라니 사빌(Melanie Saville)은 이러한 백신과 기타 차세대 코로나19 백신 개발에 대한 주요 과제는 기존 백신보다 진정한 개선을 제공한다는 것을 증명하는 것이라고 말합니다.
치열한 경쟁
모든 차세대 백신은 시장 점유율을 위해 싸워야 할 것입니다. 50개 이상의 백신이 이미 승인되었으며 초기 및 후기 임상 시험에 수백 가지가 있습니다. 수백 개가 더 버려졌습니다. ( ‘활기찬 시장’참조).
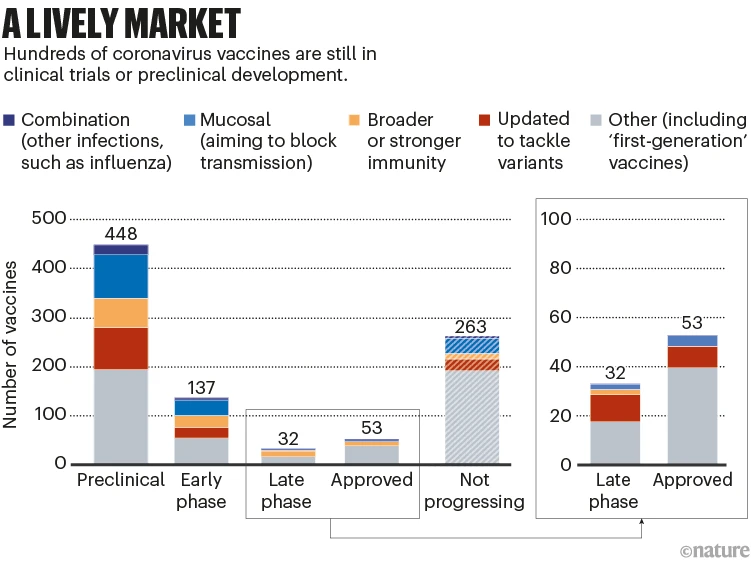
A lively market: a graph that shows the numbers and types of vaccines at different stages of development
닉 스펜서/네이처. 출처: 에어피니티
승인된 백신 중 소수만이 투여된 용량을 지배합니다(‘주요 플레이어’ 참조).
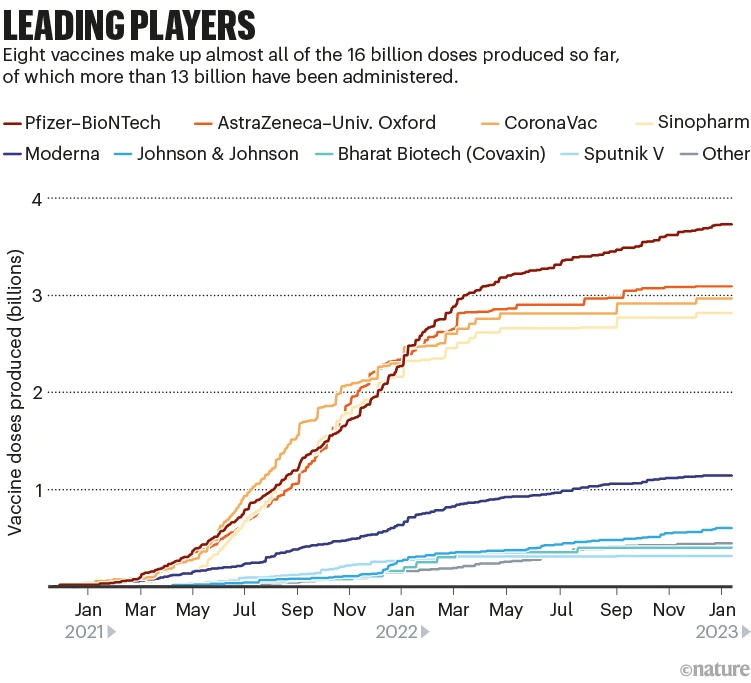
Leading players: a graph that shows the number of coronavirus vaccines produced so far by the main producers.
닉 스펜서/네이처. 출처: 에어피니티
활발한 연구에도 불구하고 Moderna 및 Pfizer-BioNTech와 같은 현재의 mRNA 잽이 지배적일 가능성이 있다고 런던의 생명 과학 정보 회사인 Airfinity의 분석 책임자인 Matt Linley는 말합니다. Omicron 성분을 포함하는 2가 백신의 빠른 개발은 이러한 백신이 신속하게 적응할 수 있음을 보여주었습니다. 또 다른 업데이트가 필요한 경우 “mRNA 예방 접종은 신속하게 대응할 수 있다는 점에서 시장 리더가 될 것”이라고 Linley는 말합니다.
COVID-19는 더 이상 예전처럼 모든 것을 포괄하는 비상사태로 간주하지 않으므로 개발자와 규제 기관은 19세대 백신의 맹렬한 속도에 비해 더 느리게 움직일 것이라고 Saville은 덧붙였습니다. “COVID-19에 대해 장기적으로 내구성이 있는 백신 유형이어야 하므로 서두르지 말아야 합니다.”
그러나 새로운 백신 기술에 관한 연구가 COVID-19에 직접적인 성과를 거두지 못하더라도 CEPI가 미래의 위협에 대한 준비를 개선하기 위해 다양한 바이러스군을 위한 ‘백신 라이브러리’에 대한 작업과 같은 다른 질병을 퇴치하기 위한 노력을 여전히 지원할 수 있다고 Saville은 말합니다.
Nature 614, 22-25 (2023)
doi: https://doi.org/10.1038/d41586-023-00220-z
